1、元素杂质来源
原料药及其制剂中的元素杂质可通过多种途径引入,如:生产设备、水、原辅料(合成中的催化剂残留)、生产设备或容器密闭系统等。由于元素杂质不能为患者提供治疗效果,因此应将元素杂质控制在可接受的限度范围内。
2、业务范围
公司配备电感耦合等离子体质谱仪 (ICP-MS)、原子吸收光谱仪(AAS)等设备,可按ICH Q3D指导原则和USP要求对原辅料和制剂中的元素杂质进行分析。
1类(药品生产中禁用或限制使用):Cd、Pb、As、Hg。
2A类(药品中出现的可能性较高,给药途径依赖型的人体毒素,):Co、V、Ni;
2B类(药品中的出现的概率相对较低,给药途径依赖型的人体毒素):TI、Au、Pd、Ir、OS、Rh、Ru、Se、Ag、Pt; 3类:Li、Sb、Ba、Mo、Cu、Sn、Cr。
3类(吸入和注射途径中中需考虑,毒性相对较低):Ba、Cr、Cu、Li、Mo、Sb和 Sn。
其他元素:Al、B、Ca、Fe、K、Mg、Mn、Na、W和 Zn等。
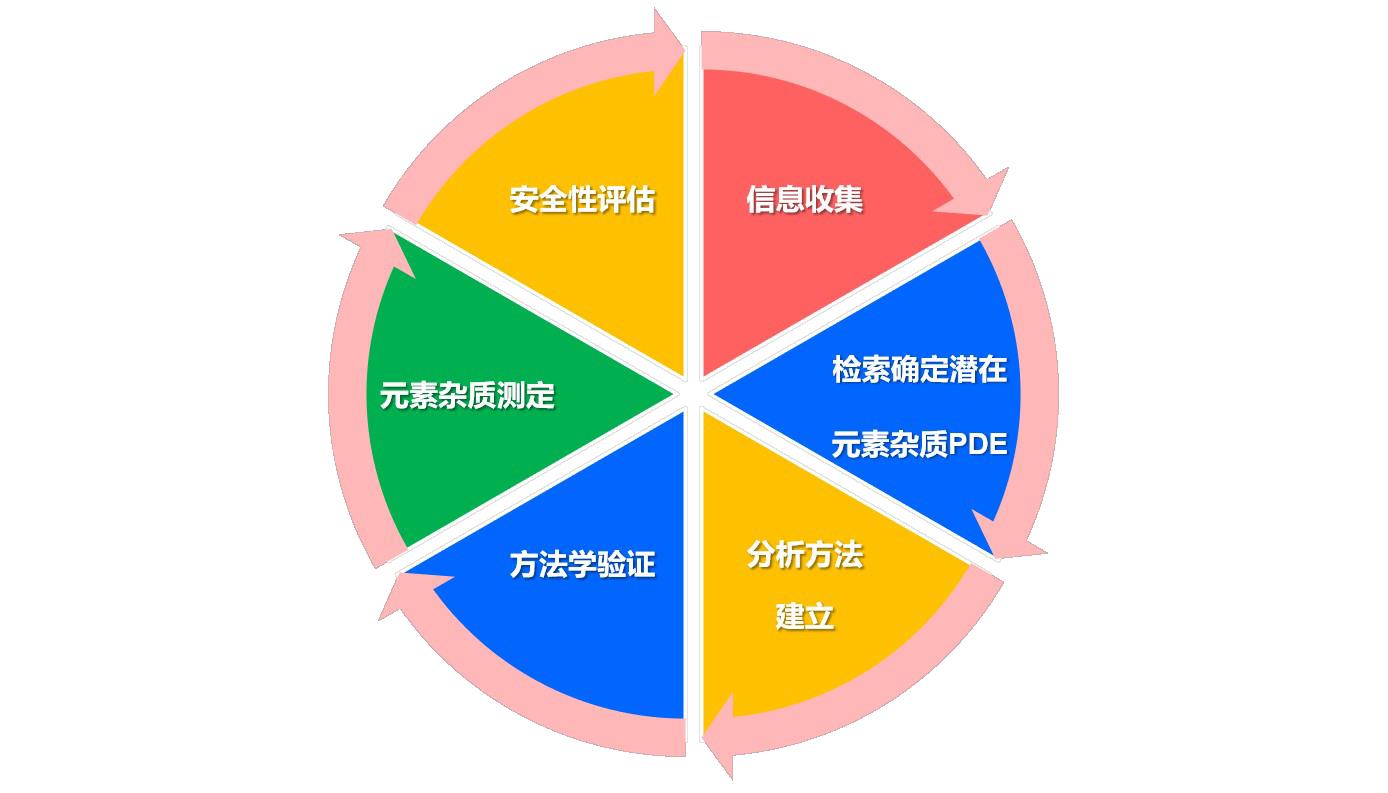
3、元素杂质测定流程
4、相关技术要求
ICH Q3D GUIDELINE FOR ELEMENTAL IMPURITIES(元素杂质指导原则)
USP<232> ELEMENTAL IMPURITIES-LIMITS(元素杂质-限度)
USP<233> ELEMENTAL IMPURITIES- PROCEDURES(元素杂质-方法)
